氰是碳和氮两种元素的化合物,化学式(CN)2,结构式N≡C—C≡N。无色带苦杏仁味的剧毒气体,其毒性与HCN相似。燃烧时呈紫红色火焰,其边缘略带蓝色。空气中最大允许浓度为10ppm。氰为直线型分子,碳氮三键的键长为115pm,碳碳单键的键长为138pm。化学性质与卤素相似故称为拟卤素。化学活性位于氯之后溴之前。可溶于水、乙醇和乙醚,加热至400℃以上聚合成不溶性的白色固体。用于有机合成和消毒、杀虫的熏蒸剂。
基本介绍
- 中文名:氰
- 英文名:cyanogen
- 别称:乙二腈、二氰
- 化学式:(CN)2
- 分子量:52.04
- CAS登录号:460-19-5
- EINECS登录号:207-306-5
- 熔点:-34.4℃
- 沸点:-21.2℃
- 水溶性:易溶于水
- 密度:0.96×103kg/m3
- 外观:无色气体
- 套用:用作熏蒸剂及有机合成原料。
- 安全性描述:S23 S45 S60 S61
- 危险性符号:易燃、有毒、危害环境
- 危险性描述:R11 R23 R50/53
- 气味:苦杏仁味(低浓度)
- 毒性:剧毒
- 摩尔质量:52.04 g/mol
- 汉语拼音:qíng
理化特性
主要成分: 纯品
爆炸上限%(V/V):42.6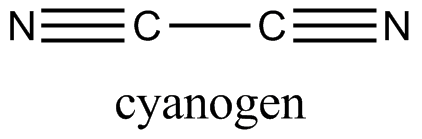 氰的化学结构式
氰的化学结构式
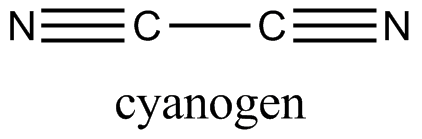 氰的化学结构式
氰的化学结构式爆炸下限%(V/V):6.6
溶解性:溶于水,易溶于乙醇、乙醚等有机溶剂。
健康危害
氰的刺激性比氰化氢略弱,而毒性则小得多。氰的轻度中毒,病人出现乏力、头痛、头昏、胸闷及黏膜刺激症状;严重中毒者,呼吸困难,意识丧失,出现惊厥,最后可因呼吸中枢麻痹而死亡。
燃爆危险
本品易燃,剧毒,具刺激性。燃烧时发出紫红色火焰,燃烧生成二氧化碳和一氧化氮。
危险特性
与空气混合能形成爆炸性混合物。遇明火、高热能引起燃烧爆炸。其蒸气比空气重,能在较低处扩散到相当远的地方,遇火源会着火回燃。遇水或水蒸气、酸或酸气产生剧毒的烟雾。若遇高热,容器内压增大,有开裂和爆炸的危险。
氰化物特指带有氰基(CN)的化合物,其中的碳原子和氮原子通过叄键相连线。这一叄键给予氰基以相当高的稳定性,使之在通常的化学反应中都以一个整体存在。因该基团具有和卤素类似的化学性质,常被称为拟卤素。一般将其无机化合物归为氰类,有机化合物归为腈类。
通常为人所了解的氰化物都是无机氰化物,俗称山奈,山埃(来自英语音译“Cyanide”),是指包含有氰根离子(CN-)的无机盐,可认为是氢氰酸(HCN)的盐,常见的有氰化钾和氰化钠。它们多有剧毒,故而为世人熟知。另有有机氰化物,是由氰基通过单键与另外的碳原子结合而成。视结合方式的不同,有机氰化物可分类为腈(C-CN)和异腈(C-NC),相应的,氰基可被称为腈基(-CN)或异腈基(-NC)。
分类
最常见的氰化物是氢氰酸、氰化钠和氰化钾。
氢氰酸,HCN,是氰化氢气体的水溶液,(HCN)是一种无色、带有淡淡的苦杏仁味气体。有趣的是,有四成的人根本就闻不到它的味道,仅仅因为缺少相应的基因。易溶于水、酒精和乙醚。易在空气中均匀弥散,在空气中可燃烧。氰化氢在空气中的含量达到5.6~12.8%时,具有爆炸性。氰化氢为气体,其水溶液称氢氰酸。氢氰酸属于剧毒类。其主要套用于电镀业(镀铜、镀金、镀银)、採矿业(提取金银)、船舱、仓库的烟燻灭鼠,製造各种树脂单体如丙烯酸树酯、甲基丙烯酸树酯等行业,此外也可在製备氰化物的生产过程中接触到本物质。
氰化钾和氰化钠都是无色晶体,在潮湿的空气中,水解产生氢氰酸而具有苦杏仁味。
氰化物拥有令人生畏的毒性,可以说,只要用舌头舐它一下就会中毒。人们在电影或电视上不止一次看到,间谍在被捕时突然咬一下衣领中预藏的氰化钾,立即就会死去。这并非戏剧夸张,一般人只要一次误服0.1克左右氰化钠或氰化钾就会中毒死亡,敏感的人甚至吃进0.06克就可以致死。这种急性中毒可以在几分钟之内猝死。因而,氰化物被称为“谋杀者毒药”。
氰化物的毒性主要由其在体内释放的氰根而引起。氰化物可由呼吸道和消化道摄入体内。氰根离子在体内能很快与细胞色素氧化酶中的三价铁离子结合,抑制该酶活性,使组织不能利用氧。当大量吞入或吸入高浓度氰化物时,中毒者随即倒地,意识丧失,瞳孔放大,迅速死亡。吞服氰化物较少者,开始感到咽喉紧缩、强烈恐惧、胸内抑闷、眩晕、呕吐、眼睛凸出,肌肉痉挛、脉搏快而弱,最后因呼吸麻痹而死,前后不过20分钟左右。摄入体内低浓度的氰化物,一部分转化成硫氰酸盐随尿排出体外,一部分逐渐在体内蓄积,久而久之,引起慢性中毒。患者头痛失眠、四肢乏力、容易疲劳、胸部与上腹有压迫感,血压下降。
产生
氰化物并非化学家的创造,恰恰相反,它们广泛存在于自然界,尤其是生物界。氰化物可由某些细菌,真菌或藻类製造,并存在于相当多的食物与植物中。例如,在杏、桃、李、枇杷、樱桃、梅等核仁中,以及在木薯、嫩毛笋、茅膏菜及嫩高粱叶中,都含有一种叫氰甙的物质,可使人中毒,最常见的是吃苦杏仁中毒。在植物中,氰化物通常与糖分子结合,并以含氰糖苷(cyanogenic glycoside)形式存在。木薯中就含有含氰糖苷,在食用前必须设法将其除去(通常靠持续沸煮)。水果的核中通常含有氰化物或含氰糖苷。如杏仁中含有的苦杏仁苷,就是一种含氰糖苷,故食用杏仁前通常用温水浸泡以去毒。
人类的活动也导致氰化物的形成。 环境中的氰化物主要来自工业“三废”,也有含氰的杀虫剂或药剂污染的,但以前者为主。汽车尾气和香菸的烟雾中还有燃烧某些塑胶也会产生氰化氢。氢氰酸是製造丙烯腈的原料,每生产10吨丙烯腈约排放50-100公斤氢氰酸。氰化钠、氰化钾用于金属电镀、矿石浮选、染料,製药、金属着色、铂金精炼等工业。显而易见,水域一旦被氰化物污染,其后果不堪构想。 .
採矿业
在广义酸硷理论中,氰离子(CN-)被归类为软硷,故而可与软酸类的低价重金属离子形成较强的结合。基于此,氰化物被广泛套用于湿法冶鍊金、银等不活泼的金属。
氰化物被大量用于黄金开採中,因为金单质由于氰离子的络合作用降低了其氧化电位从而能在硷性条件下被空气中的氧气氧化生成可溶性的金酸盐而溶解,由此可以有效地将金从矿渣中分离出来,然后再用活泼金属比如锌块经过置换反应把金从溶液中还原为金属(参见湿法冶金)。
有机合成
氰化物在有机合成中是非常有用的试剂。常用来在分子中引入一个氰基(CN-),生成有机氰化物,即腈。例如纺织品中常见的腈纶,它的化学名称是聚丙烯腈。腈通过水解可以生成羧酸;通过还原可以生成胺,等等。可以衍生出其它许多的官能团来。
中毒原理
中毒原因
无机和有机氰化物在工农业生产中套用广泛,尤其是电镀工业常用氰化物,故易获得,常被用于自杀或他杀。民间常有食用大量处理不当或未经处理的苦杏仁、木薯而致意外中毒者。
毒理作用
氰气(C2N2)一般通过呼吸道进入人体,在人体中的水发生如下反应 (此反应与卤素单质与水反应类似) 解离出剧毒的氰根离子:
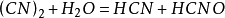
HCN=H++CN-;
氰的盐类进入人体后亦能解离出氰根离子,如:
KCN=K++CN-;
氰离子能抑制组织细胞内42种酶的活性,如细胞色素氧化酶、过氧化物酶、脱羧酶、琥珀酸脱氢酶及乳酸脱氢酶等。其中,细胞色素氧化酶对氰化物最为敏感。氰离子能迅速与氧化型细胞色素氧化酶中的三价铁结合,阻止其还原成二价铁,使传递电子的氧化过程中断,组织细胞不能利用血液中的氧而造成内窒息。中枢神经系统对缺氧最敏感,故大脑首先受损,导致中枢性呼吸衰竭而死亡。此外,氰化物在消化道中释放出的氢氧根离子具有腐蚀作用。吸入高浓度氰化氢或吞服大量氰化物者,可在2~3分钟内呼吸停止,呈“电击样”死亡。氰离子与血液中的Fe2+结合形成[Fe(CN-)6]4-,使血液运输氧的能力下降6CN- + Fe2+ = [Fe(CN-)6]4-。
毒理学
氰化物毒性:6级
毒性等级划分【致死量如下】
6级 剧毒 少于5mg/kg 少于7滴
5级 极毒 5-50mg/kg 7滴至1勺
4级 很毒 50-500mg/kg 1勺至1盎司
3级 有毒 0.5-5g/kg 1盎司至1品脱或1磅
2级 轻毒 5-15g/kg 1品脱至1夸脱
1级 微毒 15g/kg以上 1夸脱或2.2镑以上
人类的活动也导致氰化物的形成。汽车尾气、香菸的烟雾中和燃烧某些塑胶也会产生氰化氢。
中毒量致死量
口服氢氰酸致死量为0.7~3.5mg/kg;吸入的空气中氢氰酸浓度达0.5mg/L即可致死;口服氰化钠、氰化钾的致死量为1~2mg/kg。成人一次服用苦杏仁40~60粒、小儿10~20粒可发生中毒乃至死亡。未经处理的木薯致死量为150~300g。
临床表现
大剂量中毒常发生闪电式昏迷和死亡。摄入后几秒钟即发出尖叫声、发绀、全身痉挛,立即呼吸停止。小剂量中毒可以出现15~40分钟的中毒过程:口腔及咽喉麻木感、流涎、头痛、噁心、胸闷、呼吸加快加深、脉搏加快、心律不齐、瞳孔缩小、皮肤黏膜呈鲜红色、抽搐、昏迷,最后意识丧失而死亡。
尸检所见
由于血中有氰化正铁血红素形成,故尸斑、肌肉及血液均呈鲜红色。死亡迅速者,全身各脏器有明显的窒息徵象。口服中毒者,消化道各段均可见充血、水肿,胃及十二指肠黏膜充血、糜烂、坏死,胃内及体腔内有苦杏仁味。吸入氰化物中毒死亡者,大脑、海马、纹状体、黑质会有充血水肿,神经细胞变性坏死,并有胶质细胞增生,心、肝、肾实质细胞浊肿等症状。
解救
简介
急性氰化物中毒的病情发展迅速,故急性中毒的抢救应分秒必争,强调就地套用解毒剂。
1.口服中毒者,可用1:2000高锰酸钾溶液洗胃,并刺激咽后壁诱导催吐洗胃;
2.吸入中毒者,应立即撤离现场、移至空气新鲜、通风良好的地方休息;
3.用亚硝酸异戊酯1-2支击碎后倒入手帕,放在中毒者的口鼻前吸入,每2分钟一次,连用5-6次;
4.对症抢救。发生循环、呼吸衰竭者给予强心剂、升压药,呼吸兴奋剂,吸氧等;皮肤烧伤者,可用高锰酸钾溶液沖洗,然后用硫化铵溶液洗涤;
5.经上述现场急救之后,应立即送医院救治,切不可延误。
亚硝酸盐-硫代硫酸钠治疗法:
解毒机制
高铁血红蛋白形成剂如亚硝酸盐可使血红蛋白迅速形成高铁血红蛋白,后者三价铁离子能与体内游离的或已与细胞色素氧化酶结合的氰基结合形成不稳定的氰化高铁血红蛋白,而使酶免受抑制。氰化高铁血红蛋白在数分钟又可解离出氰离子,故需迅速给予供硫剂如硫代硫酸钠,使氰离子转变为低毒硫氰酸盐而排出体外。
使用方法
立即将亚硝酸异戊酯1~2支(0.2~0.4ml)包在清洁的布内压碎,给予吸入15~30秒钟,5分钟后可重複一次,总量不超过3支。小儿每次剂量为1支。本药用后在体内只形成少量变性血红蛋白,故仅作为应急措施。
3%亚硝酸钠10~15ml静注,每分钟注入2~3ml。小儿给予6~10mg/kg。以上两药均能降低血压,有循环障碍者慎用。
用同一针头以同一速度注入25~50% 硫代硫酸钠20~50ml。小儿给予0.25~0.5g/kg。必要时一小时后重複半量或全量,以后酌情重複使用。轻度中毒者单用此药即可。