主量子数是原子物理学中的概念,是与能层对应的量子数,表示原子轨道的量子数的其中一种(其他还包括角量子数、磁量子数和自旋量子数),用小写字母n表示。
基本介绍
- 中文名:主量子数
- 外文名:principal quantum number
- 定义:与能层对应的量子数叫主量子数
- 学科:物理、化学
- 涉及:量子
- 範畴:量子力学术语
基本性质
主量子数只能取正整数的值。当主量子数增加时,原子轨道变大,原子的外层电子将处于更高的能量值(能量值只能取确定的、分离的值,这些能量值称为能级),因此受到原子核的束缚更小。这是波尔模型引入的唯一一个量子数。
主量子数n是用来描述原子中电子出现几率最大区域离核的远近,或者说它是决定电子层组数的。因为电子排布遵循最低能量原理排布顺序为ns→(n-2)f→(n-1)d→np,故当主量子数等于3时能级排到1s2s2p3s3p4s3d。
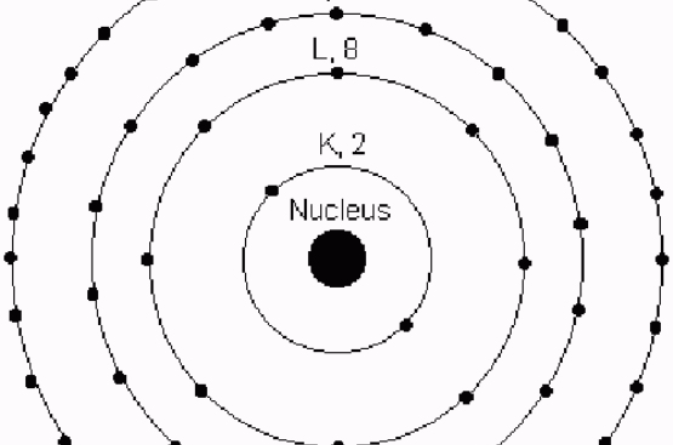
n相同的电子为一个电子层,电子近乎在同样的空间範围内运动,故称主量子数。 原子电子分布图
原子电子分布图
 原子电子分布图
原子电子分布图主量子数的n的取值为1,2,3...等正整数。例如,n=1代表电子离核的平均距离最近的一层,即第一电子层;n=2代表电子离核的平均距离比第一层稍远的一层,即第二电子层。余此类推。
可见n愈大电子离核的平均距离愈远。
在光谱学上常用大写拉丁字母K,L,M,N,O,P,Q代表电子层数。
主量子数(n)1 2 3 4 5 6 7
电子层符号K L M N O P Q 主量子数n是决定电子能量高低的主要因素。
对单电子原子来说:
n值愈大,电子的能量愈高。例如氢原子中电子的能量完全由主量子数n决定:公式见图1。 图1
图1
 图1
图1对多电子原子来说:
核外电子的能量除了同主量子数n有关以外还同原子轨道(或电子云)的形状有关。
因此,n值愈大,电子的能量愈高这句话,只有在原子轨道(或电子云)的形状相同的条件下,才是正确的。
主要作用
决定原子中电子的能量及与核的平均距离(一般能量低的趋向近轨道,r较小,反之则反),即表示电子所处的量子壳层。如K、L、M…,n=1,2,3。